Answer:
La fracción molar de la solución es 0.014 moles de hidróxido de calcio por cada mol de solución.
Step-by-step explanation:
A modo de introducción, hemos de recordar que la fracción molar se define como la cantidad de moles de soluto dividida por la cantidad de moles de la solución.
Toda solución está conformada por al menos un soluto (hidróxido de calcio) y el solvente (agua). Entonces, la fracción molar queda representada por la siguiente expresión:
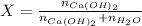
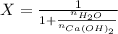
Donde:
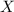 - Fracción molar de la solución, medida en moles de soluto por moles de solución.
- Fracción molar de la solución, medida en moles de soluto por moles de solución.
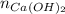 - Cantidad molar de hidróxido de calcio, medida en moles.
- Cantidad molar de hidróxido de calcio, medida en moles.
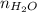 - Cantidad molar de agua, medida en agua.
- Cantidad molar de agua, medida en agua.
Sabiendo que la cantidad molar es igual la masa de la sustancia dividida por su peso molecular, podemos ampliar la expresión anterior.
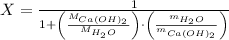
Donde:
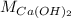 ,
,
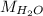 - Pesos moleculares del hidróxido de calcio y el agua, medidos en gramos por mol.
- Pesos moleculares del hidróxido de calcio y el agua, medidos en gramos por mol.
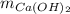 ,
,
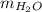 - Masas del hidróxido de calcio y el agua, medidas en gramos.
- Masas del hidróxido de calcio y el agua, medidas en gramos.
Si sabemos que
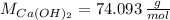 ,
,
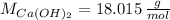 ,
,
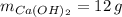 y
y
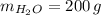 , entonces:
, entonces:
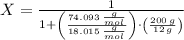
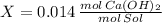
La fracción molar de la solución es 0.014 moles de hidróxido de calcio por cada mol de solución.