Answer:
1.
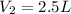
2.
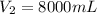
3.
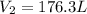
Step-by-step explanation:
¡Hola!
En este caso, dada la información para estos problemas, procedemos de la siguiente manera, basado en las leyes de los gases ideales:
1. Una masa de aire ocupa un volumen de 5 litros a una temperatura de 120 °C Cual será el nuevo volumen si la temperatura se reduce a la mitad:
Aqui, utilizamos la ley de Charles, asegurándonos que la temperatura está en Kelvin:
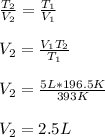
2. Un gas ideal ocupa un volumen de 4000 ml a una presión absoluta de 1500 kilo pascal Cual será la presión si el gas es comprimido lentamente hasta 750 kilo pascal a temperatura constante?
Aquí, utilizamos la ley de Boyle, dado que la temperatura se mantiene constante, calculando el volumen, ya que lo que se da es la presión final:
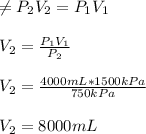
3. Un gas ocupa un volumen de 200 litros a 95°C y 782 mmHg Cual será el volumen ocupado por dicho gas a 65°C y 815 mmHg:
Aquí, utilizamos la ley combinada de los gases ideales, asegurándonos que las temperaturas están en Kelvin:
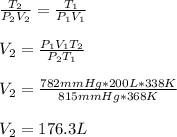
¡Saludos!