Answer:
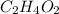
Step-by-step explanation:
¡Hola!
En este caso, dado que conocemos la composición porcentual del compuesto, es posible primero obtener la formula empírica al asumir que dichos porcentajes son gramos, que se vuelven moles con las masas atómicas de carbono, hidrógeno y oxígeno respectivamente:
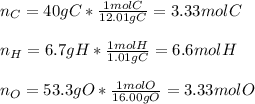
De este modo, ahora obtenemos las relaciones molares entre ellos, con el fin de obtener los subíndices en la fórmula empírica:
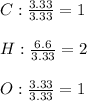
Por consiguiente, la fórmula empírica es:
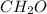
Finalmente, dado que la masa molar del compuesto es 6.0/0.10=60g/mol (dada la masa y las moles), es posible notar que como la masa molar de la fórmula empírica es 30; esta es dos veces la molecular, por lo que esta ultima resulta:
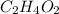
¡Saludos!