Answer:
C. 108,63 psi.
Step-by-step explanation:
Asumamos que el dióxido de carbono se comporta como un gas ideal, por la ley de Gay-Lussac tenemos que la presión del gas es directamente proporcional a su temperatura, es decir:
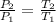 (1)
(1)
Where:
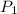 ,
,
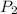 - Presiones inicial y final del gas, medidos en libras por pulgada cuadrada.
- Presiones inicial y final del gas, medidos en libras por pulgada cuadrada.
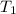 ,
,
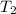 - Temperaturas inicial y final del gas, medidos en Kelvin.
- Temperaturas inicial y final del gas, medidos en Kelvin.
Si tenemos que
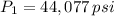 ,
,
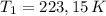 and
and
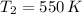 , la presión final del dióxido de carbono es:
, la presión final del dióxido de carbono es:
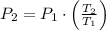
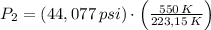
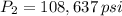
La presión final del dióxido de carbono es 108,637 libras por pulgada cuadrada. La opción correcta es C.