Answer:
Se desprenden 12 moles de hidrógeno.
Step-by-step explanation:
Para saber la estequiometría de esta reacción, primero debemos escribir la ecuación y balancearla de tal modo que de ambos lados de la flecha de reacción haya la misma cantidad de átomos (ésta es la ley de conservación de la masa). Entonces tenemos:
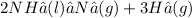
Una vez que tenemos la reacción balanceada, pordemos observar que 2 moles de amoníaco se descomponen en un mol de nitrógeno y 3 de hidrógeno, respectivamente.
Sabiendo que la masa molar del amoníaco es 17 g, pasamos el valor de 68 g a moles de amoníaco:
17 g NH₃ ------- 1 mol
68 g NH₃ ------ x= 4 mol
Ahora que tenemos este valor en moles, podemos usar la estequiometría de la reacción para calcular cuántos moles de hidrógeno se desprenden:
1 mol NH₃ ------ 3 mol H₂ (dato teórico obtenido de la ecuación)
4 mol NH₃ ------ x= 12 mol H₂
Por ende, en la descomposición de 68 g de amoníaco (o lo que es lo mismo, 4 moles de amoníaco) se desprenden 12 moles de hidrógeno.