Answer:
El reactivo limite es
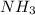 y la cantidad de urea producida es 881.58 g
y la cantidad de urea producida es 881.58 g
Step-by-step explanation:
Podemos empezar con la reacción:
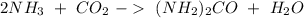
Tenemos 2 átomos de nitrógeno en ambos lados, 1 átomo de carbono en ambos lados, 2 átomos de oxigeno en ambos lados y 6 átomos de hidrógeno en ambos lados. Por lo tanto la reacción esta balanceada.
Ahora, para hallar el reactivo limite necesitamos seguir los siguientes pasos:
1) Convertir a moles usando la masa molecular de cada compuesto ( 17 g/mol para el amoniaco y 28 g/mol para el dióxido de carbono).
2) Usando el la relación molar entre cada compuesto con la urea podemos calcular las moles de urea ( para el amoniaco la relación es 2:1 y para el dióxido de carbono la relación es 1:1).
3) Finalmente, usando la masa molar de la urea (60 g/mol) podemos calcular la masa de urea.
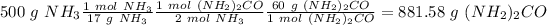
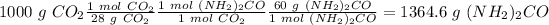
El elemento que tiene la menor cantidad de urea se da en el calculo del amoniaco. Por lo tanto, el reactivo limite es el amoniaco y la cantidad de urea producida es 881.58 g
Espero que sea de ayuda!