Answer:
El volumen del gas era 12.95 L
Step-by-step explanation:
Se relaciona la presión y el volumen mediante la ley de Boyle, que dice:
“El volumen ocupado por una determinada masa gaseosa a temperatura constante, es inversamente proporcional a la presión”
La ley de Boyle se expresa matemáticamente como: P*V=k
Por otro lado, la Ley de Charles consiste en la relación que existe entre el volumen y la temperatura absoluta de una cierta cantidad de gas ideal, el cual se mantiene a una presión constante. Esta ley dice que cuando la cantidad de gas y de presión se mantienen constantes, el cociente que existe entre el volumen y la temperatura siempre tendrán el mismo valor:
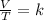
Por último, la Ley de Gay Lussac dice que la temperatura absoluta y la presión son directamente proporcionales. Es decir, cuando se mantiene todo lo demás constante, mientras suba la temperatura de un gas subirá también su presión. Y mientras la temperatura del gas baje, lo mismo ocurrirá con la presión:
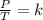
Combinado las mencionadas tres leyes se obtiene:
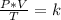
Cuando se desean estudiar dos diferentes estados, uno inicial y una final de un gas, se puede aplicar:
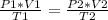
Recordando que la temperatura debe usarse en grados Kelvin, conoces los siguientes datos:
- P1: 750 torr
- V1: 8.5 L
- T1: 20°C= 293°K (siendo 0°C=273°K)
- P2: 425 torr
- V2: ?
- T2: -20°C= 253 °K
Reemplazando:
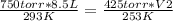
Resolviendo:
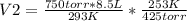
V2= 12.95 L
El volumen del gas era 12.95 L