Answer:
a) 4CH₃NH₂ + 9O₂ ⇄ 4CO₂ + 10H₂O + 2N₂
b) m = 5,043 g
c) % = 69,4 %
Step-by-step explanation:
a) La ecuación balanceada es la siguiente:
4CH₃NH₂ + 9O₂ ⇄ 4CO₂ + 10H₂O + 2N₂
En el balanceo, se tiene en la relación estequiométrica que 4 moles de metilamina reacciona con 9 moles de oxígeno para producir 4 moles de dióxido de carbono, 10 moles de agua y 2 moles de nitrógeno.
b) Para determinar la masa de nitrógeno se debe calcular primero el reactivo limitante:
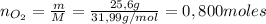
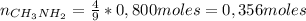
De la ecuación anterior se tiene que la cantidad de moles de metilamina necesaria para reaccionar con 0,800 moles de oxígeno es 0,356 moles, y la cantidad de moles iniciales de metilamina es 0,5 moles, por lo tanto el reactivo limitante es el oxígeno.
Ahora, podemos calcular la masa de nitrógeno producida:
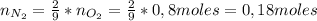
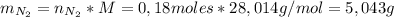
Por lo tanto, se pueden producir 5,043 g de nitrógeno.
c) El redimiento de la reacción se puede calcular usando la siguiente fórmula:
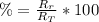
Donde:
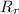 : es el rendimiento real
: es el rendimiento real
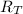 : es el rendimiento teórico
: es el rendimiento teórico
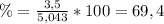
Entonces, el procentaje de rendimiento de la reacción es 69,4%.
Espero que te sea de utilidad!