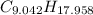Answer:
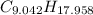
Step-by-step explanation:
(This exercise has been written in Spanish and for that reason explanation will be held in such language)
Por la definición del Número de Avogadro, un mol del compuesto contiene
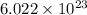 moléculas. La masa de un mol se determina mediante regla de tres simple:
moléculas. La masa de un mol se determina mediante regla de tres simple:
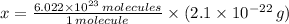
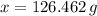
Las participaciones másicas del carbono y el hidrógeno son, respectivamente:
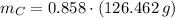
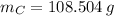
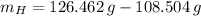
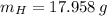
Ahora, el número de moles de cada elemento es calculado a continuación:
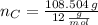
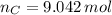
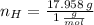
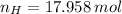
La fórmula molecular del hidrocarburo es: