Answer:
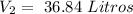
Step-by-step explanation:
En este caso tenemos diferentes valores de volumen y presión para un primer estado:
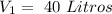
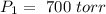
Y tenemos valores de presión para un segundo estado:
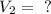
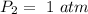
Necesitamos una relación entre volumen y presión para poder hallar nuestra incognita (
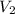 ). Nuestra relación es la ley de Boyle:
). Nuestra relación es la ley de Boyle:
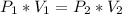
Ahora bien, tenemos una unidad diferente para el presión en
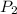 (atm), debemos hacer una conversión. Esta conversión puede hacerse si sabemos que 1 atm = 760 torr por lo cual
(atm), debemos hacer una conversión. Esta conversión puede hacerse si sabemos que 1 atm = 760 torr por lo cual
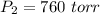
Ahora podemos reemplazar en la ecuación:
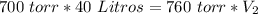
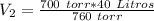
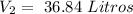
El volumen sera de 36.84 Litros
Espero que ayude!