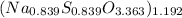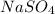Answer:
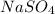
Step-by-step explanation:
Asúmase que existen 100 gramos de compuesto, las cantidades molares de cada componente son, respectivamente: (Let assume that exist 100 grams of the composite, the molar quantities of each component are, respectively:)
Na
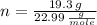
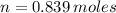
S
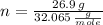
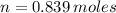
O
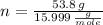
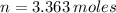
La fórmula molecular empírica es (The empirical molecular formula is):