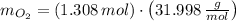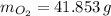Answer:
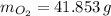
Step-by-step explanation:
La ecuación estequiométrica del proceso de descomposición es:
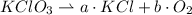
Las ecuaciones de equilibrio por elemento son las siguientes:
K:
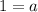
Cl:
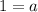
O:
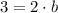
La solución del sistema de ecuaciones es a = 1 y b = 1.5. Esto significa que por cada mol de clorato de potasio que se descompone se produce 1.5 moles de oxígeno. Los pesos moleculares del clorato de potasio y el oxígeno son:
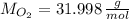
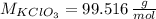
Las cantidades de moles de clorato de potasio y oxígeno son, respectivamente:
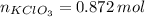
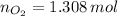
La masa producida por el oxígeno es: