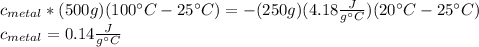Answer:
c=0.14J/gC
Step-by-step explanation:
A.
2) The specific heat will be the same because it is a property of the substance and does not depend on the medium.
B.
We can use the expression for heat transmission
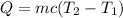
In this case the heat given by the metal (which is at a higher temperature) is equal to that gained by the water, that is to say
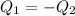
for water we have to
c = 4.18J / g ° C
replacing we have
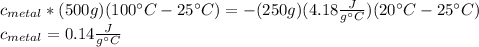
I hope this is useful for you
A.
2) El calor específico será igual porque es una propiedad de la sustancia y no depende del medio.
B.
Podemos usar la expresión para la transmisión de calor
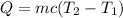
En este caso el calor cedido por el metal (que está a mayor temperatura) es igual al ganado por el agua, es decir
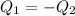
para el agua tenemos que
c=4.18J/g°C
reemplazando tenemos