Answer:
La entropía del vapor de mercurio cambia en 214.235 joules por Kelvin.
Step-by-step explanation:
Por definición de entropía (
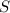 ), medida en joules por Kelvin, tenemos la siguiente expresión:
), medida en joules por Kelvin, tenemos la siguiente expresión:
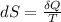 (1)
(1)
Donde:
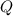 - Ganancia de calor, en joules.
- Ganancia de calor, en joules.
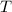 - Temperatura del sistema, en Kelvin.
- Temperatura del sistema, en Kelvin.
Ampliamos (1) por la definición de calor latente:
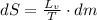 (1b)
(1b)
Donde:
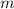 - Masa del sistema, en kilogramos.
- Masa del sistema, en kilogramos.
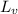 - Calor latente de vaporización, en joules
- Calor latente de vaporización, en joules
Puesto que no existe cambio en la temperatura durante el proceso de vaporización, transformamos la expresión diferencial en expresión de diferencia, es decir:
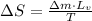
Como vemos, el cambio de la entropía asociada al cambio de fase del mercurio es directamente proporcional a la masa del sistema. Si tenemos que
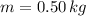 ,
,
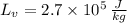 and
and
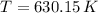 , entonces el cambio de entropía es:
, entonces el cambio de entropía es:
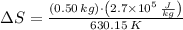
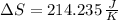
La entropía del vapor de mercurio cambia en 214.235 joules por Kelvin.