Answer:
La presion a 40 °C es 1.05 atm.
Step-by-step explanation:
Usando la ecuación ideal de los gases.
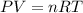
Debemos recordar, que CNPT significa condiciones normales de presión y temperatura.
Para el primer estado tenemos:
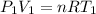
Donde:
- P(1) es la presion en el estado incial (1 atm)
- V(1) es el volumen incial (50 L)
- T(1) es la temperatura incial (25 °C = 298 K)
Para el segundo estado:
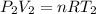
Donde:
- P(2) es la presion en el estado final ( x atm)
- V(2) es el volumen final (50 L)
- T(2) es la temperatura final (40 °C = 313 K)
Como ambas ecuaciones tienen el mismo valor de volumen podemos igualarlas:
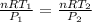
n y R permanecen constantes, se puden cancelar.
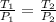
Despejamos P(2).
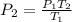
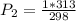
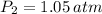
Espero te haya sido de ayuda!