Answer:
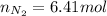
Step-by-step explanation:
¡Hola!
En este caso, teniendo en cuenta la información dada por el problema, inferimos que primero se debe usar la ecuación del gas ideal con el fin de calcular las moles de gas que se encuentran al inicio del experimento:

Seguidamente, usamos la ley de Avogadro para calcular las moles finales, teniendo el cuenta que el volumen final es el doble del inicial (8.50 L):
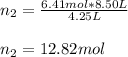
Quiere decir que las moles de N2(g) que se agregaron son:
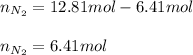
¡Saludos!