Answer:
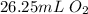
Step-by-step explanation:
¡Hola!
En este caso, dado que se nos da reacción de combustión del benceno, primero debemos balancearla como se muestra a continuación:
C₆H₆ + ¹⁵/₂ O₂ → 6CO₂ + 3H₂O
Vemos que hay una relación molar entre el benceno y oxígeno de 1:¹⁵/₂, por lo que la relación de volúmenes es:
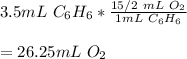
¡Saludos!