Answer:
Se obtienen 2,27 gramos de metanol.
Step-by-step explanation:
La reacción entre monóxido de carbono e hidrógeno para producir metanol es la siguiente:
CO + 2H₂ → CH₃OH
Para encontrar el reactivo limitante y el reactivo en exceso, debemos calcular el número de moles de CO y H₂:
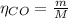
En donde:
m: es la masa
M: es el peso molecular
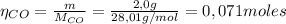
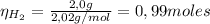
Dado que la relación estequiométrica entre CO y H₂ es 1:2, el número de moles de hidrógeno gaseoso que reaccionan con el monóxido de carbono es:
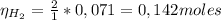
Entonces, se necesitan 0,142 moles de H₂ para reaccionar con 0,071 moles de CO y debido a que se tienen más moles de H₂ (0,99 moles) entonces el reactivo limitante es CO y el reactivo en exceso es H₂.
Ahora podemos encontar la masa de metanol obtenida usando el reactivo limitante (CO) y sabiendo que la realcion estequiométrica entre CO y CH₃OH es 1:1.
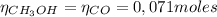
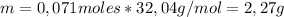
Por lo tanto, se obtienen 2,27 gramos de metanol.
Espero que te sea de utilidad!