Answer:
0.642 g
Step-by-step explanation:
La ecuación balanceada es:
- 2Mg + 2CuSO₄ + H₂O → 2MgSO₄ + Cu₂O + H₂
Primero convertimos 1.89 g de Cu₂O en moles, usando su masa molar:
- 1.89 g ÷ 143.09 g/mol = 0.0132 mol Cu₂O
Después convertimos moles de Cu₂O en moles de Mg, usando los coeficientes estequiométricos:
- 0.0132 mol Cu₂O *
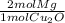 = 0.0264 mol Mg
= 0.0264 mol Mg
Finalmente convertimos moles de Mg en gramos, usando la masa molar de Mg:
- 0.0264 mol Mg * 24.305 g/mol = 0.642 g