Answer:
1.30 g
Step-by-step explanation:
La reacción que toma lugar es:
Primero convertimos 3.28 g de MgO en moles, usando su masa molar:
- 3.28 g ÷ 40.3 g/mol = 0.081 mol MgO
Después convertimos 0.081 moles de MgO en moles de O₂, usando los coeficientes estequiométricos:
- 0.081 mol MgO *
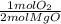 = 0.0407 mol O₂
= 0.0407 mol O₂
Finalmente convertimos 0.0407 moles de O₂ en gramos:
- 0.0407 mol O₂ * 32 g/mol = 1.30 g