Answer:
El volumen que ocupará la misma masa de aire es 839.49 mL.
Step-by-step explanation:
Las condiciones normales de presión y temperatura (abreviado CNPT) o presión y temperatura normales (abreviado PTN o TPN), son términos que implican que la temperatura referenciada es de 0ºC (273,15 K) y la presión de 1 atm (definida como 101.325 Pa).
La ley de Boyle dice que “El volumen ocupado por una determinada masa gaseosa a temperatura constante, es inversamente proporcional a la presión” y se matemáticamente como
Presión*Volumen=constante
o P*V=k
La ley de Charles es una ley que dice que cuando la cantidad de gas y de presión se mantienen constantes, el cociente que existe entre el volumen y la temperatura siempre tendrán el mismo valor:
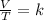
La ley de Gay-Lussac establece que la presión de un volumen fijo de un gas, es directamente proporcional a su temperatura. Se expresa matemáticamente como:
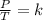
Combinando estas tres leyes se obtiene:
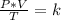
Siendo un estado inicial 1 y un estado final 2, la expresión anterior queda determinada como:
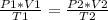
En este caso:
- P1= 101325 Pa
- V1= 773 mL
- T1= 273.15 K
- P2= 93,3 kPa= 93300 Pa
- V2= ?
- T2= 0°C= 273.15 K
Reemplazando:
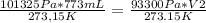
y resolviendo obtenes:
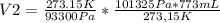
V2= 839,49 mL
El volumen que ocupará la misma masa de aire es 839.49 mL.