Answer:
Quedan 7.317 kilogramos de oxígeno en el balón y se extraen 4.683 kilogramos de oxígeno en el proceso.
Step-by-step explanation:
Asúmase que el balón es rígido. Supongamos que el oxígeno se comporta como un gas ideal, entonces la ecuación de estado es la siguiente:
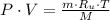 (1)
(1)
Donde:
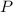 - Presión, medida en atmósferas.
- Presión, medida en atmósferas.
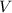 - Volumen, medido en litros.
- Volumen, medido en litros.
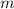 - Masa, medida en kilogramos.
- Masa, medida en kilogramos.
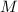 - Masa molar, medida en kilogramos por kilomol.
- Masa molar, medida en kilogramos por kilomol.
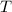 - Temperatura, medida en Kelvin.
- Temperatura, medida en Kelvin.
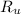 - Constante de los gases ideales, medida en atmósfera-litros por kilomol-Kelvin.
- Constante de los gases ideales, medida en atmósfera-litros por kilomol-Kelvin.
El aire experimenta un proceso isocórico e isotérmico, entonces obtenemos la siguiente relación:
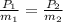 (2)
(2)
Nótese que los subíndices 1 y 2 representan los estados inicial y final de proceso.
Si sabemos que
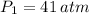 ,
,
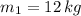 y
y
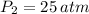 , entonces la masa final del aire es:
, entonces la masa final del aire es:
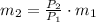
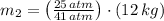
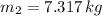
La masa que se ha extraído del balón es:
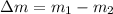
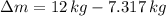
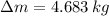
Quedan 7.317 kilogramos de oxígeno en el balón y se extraen 4.683 kilogramos de oxígeno en el proceso.