Answer:
2.61 atm
Ley de Boyle
Step-by-step explanation:
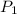 = Presión inicial = 0.96 atm
= Presión inicial = 0.96 atm
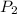 = Presión final
= Presión final
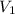 = Volumen inicial = 95 mL
= Volumen inicial = 95 mL
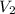 = Volumen final = 35 mL
= Volumen final = 35 mL
En este problema usaremos la ley de Boyle.
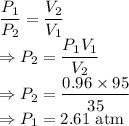
La presión ejercida sobre el émbolo para reducir su volumen es de 2.61 atm.