Answer:
Step-by-step explanation:
Dado que:
masa de oxígeno gaseoso = 100 g
presión = 1 atm
temperatura = 273 K
(a)
número de moles de oxígeno contenidos en el matraz = masa de oxígeno / masa molar de oxígeno
= 100 g / 16 gmol⁻¹
= 6.25 moles
(b) El número de moléculas de oxígeno es el siguiente:
Dado que 1 mol de oxígeno gaseoso contiene 6.023 * 10²³ moléculas de oxígeno.
Entonces, 6.25 moles contendrán:
= (6.25 × 6.023 * 10²³) moléculas de oxígeno.
≅ 3.764 × 10²³ moléculas de oxígeno.
(c) El número de átomos de oxígeno es:
= 2 × 3.764 × 10²³
= 7.528 × 10²³ átomos de oxígeno
(d) Usando la ecuación de gas ideal
PV = nRT
El volumen ocupado por el oxígeno =
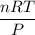
Volumen ocupado por oxígeno =
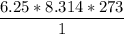
Volumen ocupado por oxígeno= 14185.76 m³