Answer:
51096J/mol = Energía de activación para el proceso del canto
Step-by-step explanation:
Podemos solucionar este problema usando una forma de la ecuación de Arrhenius:
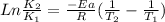
Donde K representa la velocidad de reacción (En este caso, la velocidad a la que cantan los grillos), Ea es la energía de activación, R la constante de los gases (8.314J/molK) y T representa la temperatura absoluta de 1, el estado inicial y 2, el estado final.
Estado inicial: K1 = 2.0x10²; T1 = 27°C + 273.15 = 300.15K
Estado final: K2 = 39.6; t2 = 5°C + 273.15 = 278.15K
Reemplazando en la ecuación:
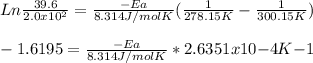
51096J/mol = Energía de activación para el proceso del canto