Answer:
2.01 A
Step-by-step explanation:
Para esta pregunta debemos empezar por la semi-reaccion del plomo:
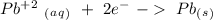
Se intercambian dos electrones en la semi-reacción del plomo. Si tenemos en cuenta la ecuación:
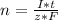
Donde:
n= Moles depositados
I= Intensidad de corriente (en Amperios)
z= Numero de electrones intercambiados
F= Constante de faraday = 96484 C/mol
t=tiempo (en segundos)
Que conocemos de esta ecuación?
Los moles (se pueden calcular a partir de la masa atómica del plomo, 207.2 g/mol)
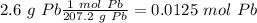
El tiempo (hay que convertirlo a segundos):
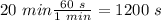
Z (Numero de electrones)
De acuerdo a la semi-reacción son intercambiados 2 electrones.
Por lo tanto podemos resolver para "I":
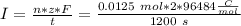
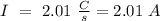
Espero que sea de ayuda!